GAZLAR KONU ANLATIMI
Maddeler tabiatta katı, sıvı ve gaz olmak üzere üç halde bulunurlar.
- Gaz hali genel olarak molekül ve atomların birbirinden uzak olduğu ve çok hızlı hareket ettiği bir haldir.
- Gaz molekülleri birbirine uzak olduğu için aralarında etkileşim yok denecek kadar azdır. Bu sebeple gaz molekülleri birbirinden bagımsız hareket ederler.
- Gazların hacim ve şekilleri işgal ettikleri kaba göre değişir. Bulundukları kabı doldururlar.
- Gazlar kolaylıkla sıkıştırılabilirler.
- Gazlar birbiriyle her oranda karışarak birinin yalnız başına işgal ettiği hacmi bu sefer beraberce doldururlar.
- Gazlar hızlı hareket ettiklerinden bulundukları kabın çeperine çarparlar ve bu çarpma neticesi kaba basınç uygularlar.
- Bulundukları kap içerisinde bütün yönlerde aynı basıncı uygularlar.
- Yoğunlukları katı ve sıvıya göre çok küçüktür.
- Isıtıldıklarında bütün gazlar sıcaklık değişimi karşısında aynı oranda genleşirler.
- Kolaylıkla bir ortamda yayılırlar.
- Gazların taneciklerinin oluşturduğu hacim, moleküller arasındaki boşluk yanında ihmal edilebilecek kadar küçüktür.
- Gaz molekülleri sabit bir hızla hareket ederken birbiriyle ya da bulundukları kabın duvarlarıyla çarpışırlar. Bu çarpışmalarda taneciklerin hızı ve doğrultusu değişebilir. Fakat çarpışmalar esnek olduğundan kinetik enerjide bir değişme olmaz.
- Gaz taneciklerinin sıcaklık değişimi ile hızları değişeceğinden ortalama kinetik enerjileri de değişir.
- Sıcaklıkları aynı olan bütün gazların ortalama kinetik enerjileri birbirine eşittir.
- Gaz molekülleri yüksek basınç düşük sıcaklıklarda sıvılaştırılabilirler.
İDEAL GAZ
Öz hacmi olmayan, moleküller arasında hiçbir itme ve çekme kuvveti bulunmayan ve gaz moleküllerinin birbiriyle çarpışmasında hiçbir kinetik enerji kaybı olmayan bir hayali gaz örneğine ideal gaz denir.
Tabiattaki gazlar gerçek gazlardır. Gerçek gazlar yüksek sıcaklık ve düşük basınçta ideale yaklaşırlar.
Farklı gazların ideal olmaları karşılaştırmasında ise;
Yoğunlaşma noktası düşük olan, molekül ağırlığı küçük olan gazlar diğerlerine göre daha idealdir, yorumu yapılabilir.
GAZLARIN ÇÖZÜNÜRLÜĞÜ
Bir gazın herhangi bir sıvıdaki çözünürlüğü;
- Gazın cinsine bağlıdır.
- Sıcaklık arttıkça azalır.
- Basınç arttıkça artar.
GAZ BASINCININ ÖLÇÜLMESİ
Gaz basıncını ölçmeye yarayan aletlere manometre denir.
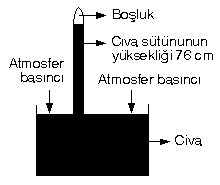
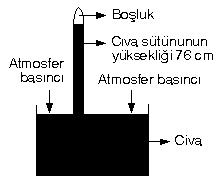
Toriçelli deniz seviyesinde civa kullanarak yapmış olduğu deney sonucu açık hava basıncını hesaplamıştır.
Sıvılar, basıncı her tarafa eşit olarak iletirler. Sıvı basıncı sıvının yüksekliğine ve yoğunluğuna bağlıdır. Cıvanın yoğunlugu 13,6 g/cm3, suyun yoğunluğu 1 g/cm3 tür.
Yukarıdaki deney civa yerine su kullanarak yapılsaydı,
Borudaki su yüksekliği: 76.13,6 = 1033,6 cm olurdu.
| 76 cm Hg = 760 mm Hg = 1 atm |
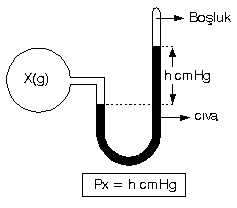
1. Kapalı Manometre
2. Açık Manometre
a.
Cıva seviyelerinin eşit olması X gazının basıncının açık hava basıncına eşit olduğunu ifade eder.
b.
X gazının basıncı açık hava basıncından h cm daha fazladır.
c.
X(g) nın basıncının açık hava basıncından daha küçük olduğu görülmektedir.
İDEAL GAZ DENKLEMİ
| P.V=n.R.T |
| P: | Basınç (atm),
76 cm Hg = 760 mm Hg = 1 atm eşitliği unutulmamalıdır. |
| V: | Hacim (ℓt) |
| n: | Mol sayısı |
| R: | Raydberg gaz sabiti olup bütün gazlar için
|
| T: | Sıcaklık birimi olarak daima kelvin kullanılır.
Kelvin = °C + 273 eşitliği vardır. |
Örnek – 1
2 mol H2 gazının 5,6 lt’lik bir kapta 8 atm. basınç yapması için sıcaklığı kaç °C olmalıdır?
Çözüm:
P.V = n.R.T denkleminden;
![]()
T= 273 °K çıkmalıdır.
Kaç °C olduğu sorulduğundan °K = °C + 273 eşitliğinden gazın sıcaklığı 0°C olacaktır.
GAZLARIN YOĞUNLUĞU
Gazların yoğunluğu basınç ve sıcaklık değişimi ile değişir.
P . V = n . R . T denkleminde;
Mol sayısını gram cinsinden yazarsak,
gazın mol sayısı; gaz kütlesinin, gazın mol ağırlığına oranına eşittir.

p.MA = d.R.t formülü çıkarılabilir.
Yoğunlukla ilgili sorularda bu eşitlik kullanılmalıdır.
Örnek – 2
N2 gazının normal koşullarda yoğunluğu 1,25 g/lt dir.
N2 gazının 0,2 atmosfer 273 °C’deki yoğunluğu kaçtır? (N : 14)
Çözüm :
P.MA = d.R.T denklemindeki sabit olan
![]()
Şartlar değişsede R değişmeyeceğinden,

Aynı gaz olduğu için MA’lar sadeleşir. Verilenler yerine yazılırsa
![]()
GAZLARIN KARŞILAŞTIRILMASI
Farklı gazlar birbiriyle karşılaştırıldığında ya da herhangi bir gazın farklı ortamlardaki halleri birbiriyle kıyaslandığında;


Buradan genel olarak aşağıdaki formül çıkarılır.
Formül karşılaştırma sorularında kullanılacaktır.
Örnek – 3
2 litre hacimli kapta mutlak sıcaklığı T olan m gram CH4 gazı, 3 litre hacimli kapta mutlak sıcaklığı 2T olan 2m gram SO2 gazları vardır.
SO2 gazının basıncının CH4 gazı basıncına oranı kaçtır?
(H : 1, C : 12, O : 16, S : 32)
Çözüm
CH4 gazı için basınç : ![]() , hacim 2 litre, sıcaklık T dir.
, hacim 2 litre, sıcaklık T dir.
![]()
SO2 gazı için basınç : ![]() , hacim 3 litre sıcaklık 2T dir.
, hacim 3 litre sıcaklık 2T dir.
![]()

Örnek – 4
Aşagıdaki grafiklerden hangisi yanlış çizilmiştir?

Çözüm:
P.V = n.R.T denklemi esas alınarak yorumlanırsa A, B, C, E şıklarında çizilmiş olan grafikler doğru çizilmiştir. D şıkkında ise basınç, °C grafiği, gazın sıcaklığı 0 °C iken
273°K’dır. Basıncı sıfır olamaz. Yani grafik sıfır noktasından başlayamaz.
Cevap D
GAZLARIN KARIŞTIRILMASI
Farklı kaplarda bulunan gazların yeni bir kapta karıştırılması ya da musluklarla birbirine bağlı olan kapların musluğunun açılması ile gazların birbirine karıştırılması şeklindeki soru tipleri bu başlıkta incelenecektir. Karıştırılan gazlar birbiriyle reaksiyon verebilir ya da vermeyebilir.
Gazlar sabit sıcaklıkta karıştırılıyorsa;
P.V = n.R.T denklemine göre;
T sabit ise, P.V değeri, mol sayısı (n) ile doğru orantılıdır.
Gazlar karıştırıldığında;
| Pson.Vson =P1.V1.+P2.V2+……………Pn.Vn |
formülünden yararlanarak işlemler yapılır.
KISMİ BASINÇ
Kısmi basınçtan bahsedilebilmesi için aynı kap içerisinde birden fazla gazın bulunması gerekir. Kapta bulunan bütün gazlar için hacim (V) ve sıcaklık (T) aynı olacağından, basınç mol sayısıyla doğru orantılı olacaktır.
![]()
PA : A gazının kısmi basıncı
nA : A gazının mol sayısı
nT : Toplam mol sayısı
PT : Toplam basınç
Kısmi basıncı, karışımdaki herbir gazın tek başına o kabı doldurduğunda yapacağı basınç olarak da tarif edebiliriz. Herbir gazın yapmış olduğu kısmi basınçların toplamına ise toplam basınç denir.
Örnek- 5
4 mol H2, 3 mol CO2 ve 2 mol He gazının bulunduğu kabın toplam basıncı 1,8 atm.’dir.
Buna görenin kısmi basıncı nedir?
Çözüm:
Kısmi basınç sorularında aynı kapta birden fazla gazın bulunması söz konusudur. Dolayısıyla herbir gaz için hacim (V) ve sıcaklık (T) aynıdır.

GAZLARIN KİNETİĞİ VE DİFÜZYON HIZI
Gazlar uzayda birbirinden oldukça uzak mesafelerde hareket eden moleküller topluluğu olup, gaz taneciklerinin öz hacmi gazın kapladığı toplam hacim yanında yok denecek kadar azdır.
Gaz molekülleri sabit bir hızla hareket ederler ve bu hareketleri sırasında birbirleriyle ve içinde bulundukları kabın çeperiyle çarpışırlar. Bu çarpışmalar esnek olup çarpışma sırasında kinetik enerji değişmez.
Gaz molekülleri ısı enerjisini kinetik enerjiye dönüştürürler. Sabit sıcaklıkta bütün gazların ortalama kinetik enerjileri aynıdır.
Yani kinetik enerji yalnızca sıcaklığa bağlıdır.
Difüzyon hızı için;
Aynı basınç ve sıcaklık altında X ve Y gazlarını özdeş bir kaba koyalım. Bu iki gazın ortalama kinetik enerjileri birbirine eşittir.

Molekül ağırlığı küçük olan gazlar hızlı, büyük olan gazlar yavaş hareket ederler.
Aynı formülden hız ile yoğunluk arasında;  eşitliği de çıkarılabilir.
eşitliği de çıkarılabilir.
Kinetik enerjisinin sıcaklık ile ilişkisi ![]() şeklindedir.
şeklindedir.
İki denklem birleştirilirse,

eşitliğide çıkarılır. Yani mutlak sıcaklık 4 katına çıkarıldığında hız 2 katına çıkar.
SIVI-BUHAR BASINCI
Sıvıların her sıcaklıkta buharlaşabildiklerinden sıvı buharlasının bu sıcaklıklarda yapmış olduğu basınca sıvı-buhar basıncı denir.
- Sıvı – buhar basıncı, sıvının cinsine ve sıcaklığına baglıdır. Sıvı miktarına bağlı değildir.
- Sıvı – buhar basıncı, açık hava basıncına eşit olduğunda sıvı kaynamaya başlar.
- Sıvı – buhar basıncı büyük olan sıvıların kaynama noktaları düşüktür.
- Sıvı – buhar dengesinde iken sıvı buharları sıkıştırılırsa ya da genleştirilirse basıncı değişmez.
- Uçucu sıvıların sıvı – buhar basınçları daha yüksektir ve bu sıvılar daha düşük sıcaklıkta kaynar.
- Bir sıvı içinde herhangi bir katı madde çözülürse, sıvı – buhar basıncı düşer dolayısıyla kaynama noktası yükselir.
- Sıcaklık arttıkça sıvı – buhar basıncı artar.
öğretmenimiz çok beğendi, Gazlar Konu Anlatımı – Ders Notları – Kimya süper yazılmış, artı olarak belirteyim kıskanmayın ama sınıfın en çalışkan kızıyım ben.
Gerçekten güzel bilgiler teşekürlerr
cidden elinize sağlık ortada bir emek var hepinize teşekkürler işe yaramadı
Yarın kimya sınavı var baya kötü koyacak gibi hoca sınavı sorunca pis pis sırıyo allah yardımcımız olsun
haklısın kardeşim kimya çok fena giriyor
Çok güzel anlatılmış ..
Çok iyi ya gazlar konu anlatımı sayesinde çözdüm olayı sağ olun.
Örnek 5 hakkında bi eksiklikmi var acil ödev yarın teslim bilgi verirmisiniz
Co2nin diyecekti orda kardesim verilen denklemden anladığım bu
gazlar konusu çok karısık
çook güzel bir anlatım söz konusu…
Çok beğendim, süpersiniz kimyaya aşığım yha .s.s kız arkadaşım da çok beğendi lebezyem forever
sevgilimin projesini yaptım 100 almış çok teşekkürlerr
arkadaşım sevgilin seni kandırmış:D
Mehmet komik misin sen ya
Hâlâ sevgili misiniz bari? Boşa gitmesin onca şey.
Bence değiller.
Selam sevgilim.
dünya hayatı boş iş… (BTÜ den selamlar) HİÖ
Yarın yazılım var inşALLAH yardımcı olur… Teşekkürler…..
çok sağol mümin kardeşim Allah seni sediğine bağışlasın
yaa gazların ıcel ozellıklerı bunlarmı ACILL
insanlar burda birilerine dersler konusunda yardım etmeye çalışıyor şahsen benim çok işime yaradı teşekkürlerimi sunuyorum fakat bu konuyu anlamayan arkadasların burda gelipte bunu hazırlayanlara birtakım laflar etmesi kadar gereksiz bir şey olamaz,begenmediysen bunu belirtebilir ve başka kaynaklardan yararlanabilirsin,böyle saçma ve gereksiz eleştirilerinizi kendinize saklayın bu insanların tek amacı yardımcı olmak
o eleştiri yapanlar daha iyisini yapsın sonra konuşsun demi?
hatice seni seviyorum….
saolun erkek arkadaşımın ödevini yapmama yardımcı oldunuzzz
Arkadaşım beynini daha etkin kullanmalısın . ALLAH seni ıslah etsin . Soyadını , tipini bilmediğin kıza sadece kız olduğu için yavşayan beyinsiz .
bende seni ahmet
Ve Kum için artık bitkisel hayat…
yarın sınavım var .calıtım ama gec basladığım için yeterli olmuyo sanırım. allah hepimize yardım etsin
hepiniz çok gerizekalı insanlarsınız
sen çok AKILLISIN KENDİNE BAK KAFAMI BOZMA
İnsan kendisi neyse karşındakilerinide öyle görmek istermiş sende aynı hesapsın işte
Kumao(teşekkürler)çok işime yaradı
Örnek 3’te cevap 1/3 değil 2/3 olacak. Çünkü m/64 olarak almışsınız ama soruda 2m diyor yani 2m/64 yazılması gerekiyordu. Bu arada çok güzel bir konu anlatımı, teşekkürler :)
Tebrik ediyorum seni
Teşekkürler çok işime yaradı yazılıdan 80 aldım
can okuyalım, caz dinleyelim…
teşekkürler çok iyi lakin soru çözmemde yetersiz kalıyor. :(
ödevimi yapmama yardımcı oldu çok teşekkür ederim
terbik etiyorum
hiçh phir işimhe yharamhadı .xDxDxD
Sen anlayamazsın dilinde yazılmamış :D Kimyayı bosver Türkceye Yönel :D
Sana farklı bir dilde bi anlatım lazım zaten 10. sınıfa bu ergenlikle nasıl geldiysen
Kavram haritası var mı ? Bilen link atsın gazlar ve özellikleri ile ilgili
güzel bilgiler ama hala testleri çözemiyorumm. yetersiz kalıyo birazzzzzz
çok yararlı teşekkür ederim çok guzel anlatilmis
gerçekten çooook teşkkrrlr yarn sınav var derste anlamadıgımı şimdi anladm :)
güzel ama çok karma karışık anlatmışsınız çok uzamış.
Saolun çok işime yaradı…
Çok saolun İsa sizden razı olsun Tanrı sizi kutsasın
ya kutsal ruh?
örnek 3teki cevap yanlış 2\3 olucak çünkü 2m verilen so2’nin ağırlığı çözümde m\64 alınmış 2m\64 olması gerek
Teşekkürler dikkat etmemiştim :)
En yakın zamanda düzeltilir de başkaları da bu hataya düşmez :)
yıllık ödev için mükemmel bilgiler çok işime yaradı
işime çok yaradı tesekkürler.
öncelikle hanımefendi ananızın ellerinden yanaklarından öpüyorum çok işimize yaradı ez ji te hezdikmn
Çok işime yaradı teşekkürler. ama gazların şekilli soruları olsaydı daha iyi olurdu . . )
doğru dürüst hiç bir işime yaramadı video koysanız konu anlatımlı daha iyi olurdu yazanlar her kaynakta var zaten
çok güzel
gayet güzel anlatmışlar. birde gazların su üzerinde toplanması ile ilgili örnekler yapılırsa güzel olurdu :)
hiç bir yararı olmadı adam akıllı bir anlatım videosu koysanız daha mantıklı olacak ve bu anlattıklarınız zaten kitaplarda var
Bazı seyleri yarım yapmışlar ama olsun :D :D :D xD
çok teşkkrlr gerçktn işime yarayack gibi :D
Merwe seni seviyorum