
• ATOM ve YAPISI
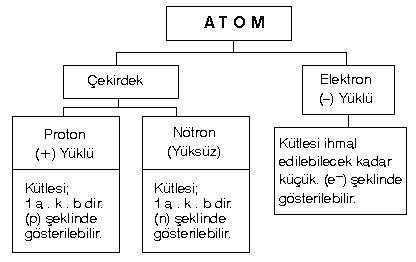
Elementin özelliğini taşıyan en küçük parçasına denir.
.
.
.
.
.
.
.
Atom Numarası
Bir elementin unda bulunan proton sayısıdır. Protonlar (+) yüklü olduklarından pozitif yük sayısı ya da çekirdek yükü şeklinde ifade edilebilir.
| Atom numarası = Proton sayısı = Çekirdek yükü |
| Kütle Numarası = Proton sayısı + Nötron sayısı |
eşitliği yazılabilir.
Nötr (yüksüz) bir için, çekirdekte kaç proton varsa çekirdeğin etrafındaki yörüngelerde de o kadar elektron dolaşır.
İYON
(+) veya (–) yüklü ya da gruplarına iyon denir.
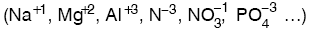
- elektron verirse (+) yüklü iyon oluşur ve katyon olarak isimlendirilir.
- elektron alırsa (–) yüklü iyon oluşur ve anyon olarak isimlendirilir.
Bir X atomu için; ![]() gösterilir.
gösterilir.
Buradan nötron sayısı, elektron sayısı bulunabilir.
İZOTOP
numaraları aynı kütle numaraları farklı olan atomlara izotop atomlar denir.
![]() birbirinin izotopudur.
birbirinin izotopudur.
- İzotop atomların kimyasal özellikleri aynıdır. Fiziksel özellikleri farklıdır.
- İzotop iyonların elektron sayıları farklı ise kimyasal özellikleri de farklıdır.
ALLOTROP
Kimyasal özellikleri aynı (aynı dan oluşmuş), fiziksel özellikleri (renk, kaynama noktası, erime noktası, uzaydaki dizilişleri v.s.) farklı olan maddelere allotrop maddeler denir.
Elmas, grafit, amorf karbon, üç madde de yapısında yalnızca karbon (C) u içerir. Fakat uzaydaki dizilişleri ve bağların sağlamlığı farklı olan maddelerdir.
O2 gazı ve O3 (Ozon) gazı birbirlerinin allotropudur. Allotrop için bilinmesi gereken en önemli özellik ise;
Allotrop maddeler bir başka madde ile reaksiyona girdiklerinde aynı cins ürünler oluşur.
2Ca + O2 ® 2CaO
3Ca + 2/3 O3 ® 2CaO gibi.
Modern Teorisi
- Elektron dalga özelliği göstermektedir.
- Atomdaki elektronun aynı anda yeri ve hızı bilinemez.
- Elektronların bulunma ihtimalinin fazla olduğu küre katmanları vardır ve bu katmanlara orbital denir.
ELEKTRONLARIN DİZİLİŞİ
Pauli Prensibi
- Elektronlar yörüngelere yerleştirilirken ;
- 2n2 formülüne uyarlar.
(n : yörünge sayısı, 1,2,3 ………. gibi tamsayılar) - Son yörüngede maksimum 8 elektron bulunur.
Buna göre, her yörüngedeki elektron sayısı :
1. yörünge : 2.12 = 2 elektron
2. yörünge : 2.22 = 8 elektron
3. yörünge : 2.32 = 18 elektron
4. yörünge : 2.42 = 32 elektron alır.
Elektronik konfigürasyon
Bir atomun elektronlarının hangi yörüngede olduğu ve orbitallerinin cinsinin belirtildiği yazma düzenine Elektronik konfigürasyon denir.
n : Baş kuant sayısı olup 1, 2, 3, … gibi tam sayılardır. Elektronun hangi yörüngede olduğunu belirtir.
l : Yan kuant sayısı olup, orbital adı olarak bilinir, s, p, d, f gibi harflerle anılır.
Elektronlar önce düşük potansiyel enerjili orbitallere yerleşirler. Dört değişik enerji düzeyi vardır.
s : Enerji seviyesi en düşük orbitaldir. 2 elektron alabilir.
p : s orbitalinden sonra elektronlar p orbitallerine yerleşir. px , py , pz olmak üzere 3 tanedir. p orbitalleri toplam 6 elektron alabilir.
d : 10 elektron alır ve toplam 5 tanedir. p orbitallerinden sonra elektronlar d orbitallerine yerleşirler.
f : f orbitalleri toplam 14 elektron alır ve 7 tanedir. Enerji düzeyi en yüksek olan orbitaldır.
| Yörünge Sayısı (n) | Yörüngedeki orbital sayısı(n2) | Yörüngedeki elektron sayısı (2n2) |
| 1………. | 1 (1 tane s) | 2 |
| 2. ……… | 4 (1 tane s, 3 tane p) | 8 |
| 3. ……… | 9 (1 tane s, 3 tane p, 5 tane d) | 18 |
| 4. ……… | 16 (1 tane s,3 tane p, 5 tane d, 7 tane f) |
32 |
Bir atomun elektronları yörüngelere yerleştirilirken okların sırası takip edilir. Bunlar bu sıra ile yazılırsa aşağıdaki gibi olur.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
Peryot : Dizilişi yapılan elementin en son yazılan s orbitalinin başındaki sayıya periyot denir.
Grup : Son yörünge orbitalleri s ve p ile bitiyorsa A grubu, d ve f ile bitiyorsa B grubu elementidir.
- A grupları son yörüngelerindeki s ve p orbitallerindeki elektronların toplamıyla bulunur.
X: 1s2 2s2 2p6 3s2 3p6 dizilişine göre atom 3. periyot, 8A grubundandır.
PERİYODİK TABLO
- Elementlerin atom numaralarına göre belirli bir kurala uyarak sıralanması ile periyodik cetvel oluşur.
- Periyodik cetvelde yatay sıralara periyot, düşey sıralara grup denir. Periyodik cetvelde 7 tane periyot, 8 tane A grubu, 8 tane B grubu vardır. 8B grubu 3 tanedir. Her periyot kendine ait olan s orbitali ile başlar p orbitali ile biter. Diger bir ifade ile 1A grubu ile başlayıp 8A grubu ile sona erer.
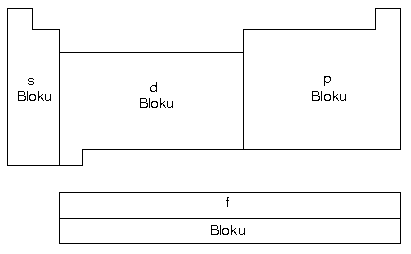
- A grubu elementleri s ve p blokunda,B grubu elementleri d ve f blokunda bulunurlar.
B grubu elementlerine geçiş elementleri denir. Bunların tamamı metaldir.
- Periyodik cetvelde A grubu elementlerinin özel isimleri vardır.
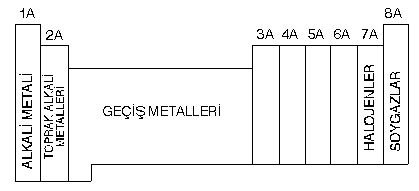
- Periyodik cetvelde aynı grupta bulunan elementlerin değerlik elektron sayıları aynı olduğundan benzer kimyasal özellik gösterirler.
| METAL-AMETAL ve SOYGAZ’IN ÖZELLİKLERİ | ||
| Metal | Ametal | Soygaz |
|
5A(-3),6A,(-2)7A(-1)… Fakat(+) değerlik alabilirler.
|
|
• BİLEŞİK OLUŞUMU
a. Metal + Ametal
b. Ametal + Ametal
Metaller son yörüngelerindeki elektronları vererek (+) değerlik alırlar.
Ametaller ise son yörüngedeki elektronları 8’e tamamlamak için elektron alarak (-) değerlikli olurlar.
Bileşik formülünü bulabilmek için öncelikle bileşiği oluşturacak elementlerin değerlikleri tespit edilir. Bu değerlikler en küçük katsayılar şeklinde çaprazlanır.
En genel ifadesi ile X+m ile Y-n iyonu XnYm
bileşiğini oluşturur.
Bileşiği oluşturan atomların her ikisi de ametal olduğunda farklı bileşik formülleri oluşabilir.
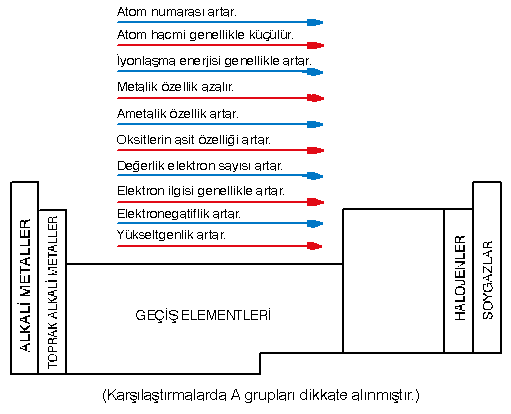
ATOM ve İYON ÇAPI (HACMİ)
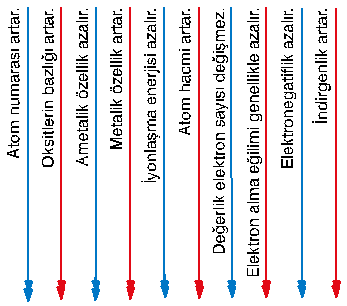
- Peryot numarası (yörünge sayısı) arttıkça atom hacmi büyür.
- Grup numarası arttıkça atom hacmi küçülür. Çünkü yörünge sayısı aynı kalmakta fakat çekirdek yükü ve çekirdeğin elektronları çekme gücü artmaktadır.
- Bir atom ya da iyon elektron aldıkça çapı büyür, elektron verdikçe çapı küçülür.
Örneğin; X atomunun hacmi X-n iyonunun hacminden küçük, X+n iyonunun hacminden büyüktür.
Örnek – 1
6C, 14Si, 3Li
atomlarının çaplarını karşılaştırınız?
Çözüm
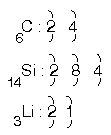
Peryot numarası büyük olanın çapı en büyük olduğundan Si çapı en büyüktür.
6C, ile 3Li aynı peryotta olduğundan, grup numarası (proton sayısı) arttığı için
çekirdek çekimi büyük olanın çapı küçük olacağından 3Li çapı 6C nun çapından büyüktür. Sonuç olarak çaplar arasında Si > Li > C ilişkisi vardır.
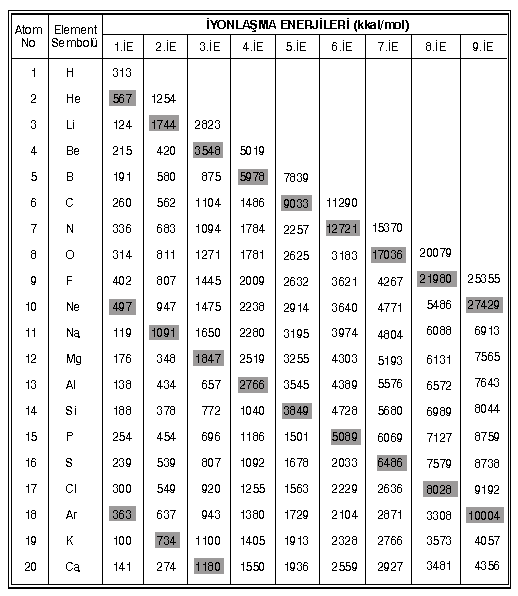
İYONLAŞMA ENERJİSİ
Gaz halindeki bir atomdan bir elektron koparmak için verilmesi gereken enerjiye iyonlaşma enerjisi (1. iyonlaşma enerjisi) denir.
2’inci elektronu koparmak için verilen enerjiye 2. iyonlaşma enerjisi denir.
3’üncü elektronu koparmak için verilen enerjiye 3. iyonlaşma enerjisi denir.
Herhangi bir atom için daima 1.i.E < 2.i.E < 3.i.E … geçerlidir. Yani bir sonraki elektronu koparmak daha fazla enerji gerektirir.
- Periyot numarası arttıkça iyonlaşma enerjisi azalır.
- Gruplarda iyonlaşma enerjisi sıralaması,
1A < 3A < 2A < 4A < 6A < 5A < 7A < 8A
şeklindedir.
Örnek – 2
Bir X atomu için;
| X(g) ® X+2(g) + 2e–X+1(g) ® X+2(g) + e–
X+1(g) ® X+3(g) + 2e– |
DH = 340 k.kal.DH = 215 k.kal.
DH = 625 k.kal. |
Verildiğine göre X atomunun 1. iyonlaşma enerjisi, 2. iyonlaşma enerjisi ve
3. iyonlaşma enerjisi değerleri kaçtır?
Çözüm
1. denklem: 2 elektronu uzaklaştırmak için verilen enerjidir. Yani 1. ve 2. iyonlaşma enerjileri toplamıdır. 2 elektronu koparmak için toplam 340 k.kal enerji harcanmıştır.
215 kkal. 2’inci elektronu uzaklaştırmak için verilen enerji olduğuna göre 2. iyonlaşma enerjisi 215 k.kal’dir. O zaman 340 – 215 = 125 k.kal 1. iyonlaşma enerjisidir. 625 k.kal. X atomunun 1 elektronu uzaklaşmış durumundan 2e– daha uzaklaştırmak için gereken enerjidir. (Yani: 2. ve 3. iyonlaşma enerjileri toplamıdır.)
2. İ.E = 215 k.kal olduğuna göre;
3. iyonlaşma enerjisi = 625 – 215 = 410 k.kal dir.
ELEKTRON İLGİSİ
- Gaz halindeki nötr bir atomun elektron yakalamasıyla açığa çıkan enerjidir. Açıga çıkan enerji ne kadar büyük ise elektron ilgisi o kadar fazladır.X(g) + e– ® X–(g) + Enerji
- Periyodik cetvelde 7A grubu elementlerinin elektron ilgisi en büyüktür.
- Metallerin ve soygazların elektron ilgileri yok kabul edilir.
KİMYASAL BAĞLAR
Bileşiğin en küçük parçası olan ve en az iki atomun birleşmesinden meydana gelen kararlı yapı moleküldür. Moleküldeki atomları bir arada tutan kuvvet ise kimyasal bağlardır.
Kimyasal bağlar ikiye ayrılır.
1. İyonik bağ
2. Kovalent bağ
İYONİK BAĞ
- Metallerle ametaller arasında meydana gelen bağlardır. Metaller elektron vererek (+) yüklü iyon, ametaller elektron alarak (-) yüklü iyon oluştururlar. Bu zıt yüklü iki iyonun birbirlerini coulomb çekim kuvveti ile çekmesinden iyonik bag oluşur.
- Örnek olarak NaCI bileşiğinde Na atomunun iyonlaşma enerjisi küçük olduğundan 1 tane değerlik elektronunu vererek (+1) yüklü iyon, klor ise Na atomunun verdiği elektronu alarak (-1) yüklü iyon oluşturur. Bu iki iyonun birbirini coulomb çekim kuvveti ile çekmesi sonucu NaCI bileşiği oluşur ve meydana gelen bağ iyonik bağdır.
- iyonik bağ oluşurken metal ve ametal ne kadar aktifse bağ o kadar sağlam olur.
Örnek – 3
13Al ve 16S atomları arasında oluşan bileşiğin 1 molekülü için:
I. Al atomları toplam 6 elektron verir.
II. S atomları toplam 3 elektron verir.
III. Al2S3 iyonik bileşiği oluşur.
hangileri doğru olur?
| A) Yalnız I | B) Yalnız III | C) I ve III | |||
|
|||||
Çözüm
Al ve S atomlarının elektronlarının dizilişi
Al : 1s2 2s2 2p6 3s2 3p1
S : 1s2 2s2 2p6 3s2 3p4
şeklindedir. Al atomunun son yörüngesinde 3 elektron, S atomunun son yörüngesinde 6 elektron vardır. Al metal, S ametaldir.
Al ve S atomu arasında oluşan bileşik (Al+3 ve S-2 iyonlarının yükleri çaprazlanırsa) Al2S3 olarak bulunur. Oluşan bileşik iyonik bileşiktir.
Al2S3 bileşiğinde 2 tane Al atomu vardır. 1 tane Al atomu 3 elektron verdiğinden 2 tane Al atomu 6 elektron verir. 3 tane S atomu 6 elektron alır.
Buna göre I ve III dogru, II yanlıştır. Cevap C’ dir.
KOVALENT BAĞ
- Ametallerin (C, N, P, S, O, H, F, CI, Br, I) kendi aralarında elektron ortaklığı ile oluşturdukları bağdır.
- Örnek olarak hidrojen molekülü arasındaki bağı incelersek;
- Hidrojenin atom numarası 1 olduğundan, 1 tane elektronu vardır. Bu elektron 1s orbitalinde bulunmaktadır. ıki hidrojen atomundaki birer elektronun etkileşmesinden H2 molekülü oluşur, aradaki bağ kovalent bağdır. Hidrojen molekülü H• •H veya H–H şeklinde gösterilir.
- Aynı cins ametal atomları arasında oluşan kovalent bağ apolar, farklı cins ametal atomları arasında oluşan kovalent bağ polardır. H2 molekülündeki H – H bağı apolar, HCl molekülündeki H – Cl bağı polardır.
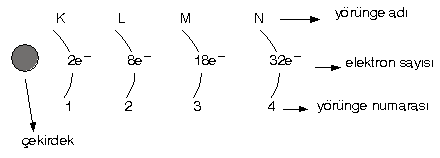
bence çok güzeldi iyi hazırlık olur sınava
tesekürler ders şeklini beğendim
İyi, ben şahsen çok beğendim, atom ödevi kısa ve özenle hazırlanmış, emeği geçenlere teşekkürler, hem çok zeki hem de çalışkan biri olarak herkese öneririm. :)
iyi değil
Aynen
Benimde proje ödevim periyodik tabloydu bende burdakilerini yazdım hoca beğendi tesekkurlerrrr ?☺??? :) :) !!
Güzel anlatılmış
Bence güzel bir anlatım tsk..
Formüllerin ve bazı bilgilerin özet olarak verilmesi güzel olmuş, kimyayı sevmeye başlıyorum.
sınav öncesi iyi bir tekrar oldu teşekkürler.
Aynen harika bir sayfa olmuş.
Teşekkürler güzel olmuş daha iyisi yok zaten.
Sana dduz dalaram ha tembel yorum yazma p*ç
Arkadasim burasi babanin ahiri degil anladin mi her agzina geleni soyleyemezsin beynin var gibi davran yorumunu yazarken
begendim isime yaradi
teşekkürler çok yardımcı oldu :)
İyi yapılmış…
Ellerinize sağlık.Buradan performans ödei hazırlamayı düşünüyorum.
İnsan altına 2 soru koyar
Sen dua et adsm konu anlatımı yapmış
eywallah ellerinize saglik
cogu yanlış
örnek verebilir misin acaba? buradan performans ödevi yapmayı düşünüyordum da böyle bir yorum görünce vazgeçtim gerçekten hatalı mı?
Fena degil
Daha iyisi olabilirdi ama…
pardon da gayette güzel anlatmış daha ne bekliyodun
Aferin sana. Aferinn
çok güzel olmuş teşekkürler :)
iyiymiş:)
çok güzel teşekkür ederim
Numarani yazarmsn
çook güzell olmuş Allah razı olsun
abii çokk iyii yaaaa … :)))
Çok güzel hazırlanmış . Sayısal öğrencisiyim ve bu konuyu çok iyi anlatan bir özet sağolun.
çoook iyi tesekkürlerrr :)
seni doğurtan kafamı anladın sen
kardeş mühendislikte okuyorum gayette ıyı olmuş vizeye buradan calısacagım . tokat / gaziosmap paşa üni :) basarılar
güzeldi.teşekkürler… :)
çok kötü
erkek ollan var mııı gelsin tanısalım 17 yasındayım çok güzelim
tamam olur bnde 20 yasındayım bebegim
amacın ne kızım bizde 19 yaşıundayız kendini beynmiş kokoş gözlerim yeter ayıks
Var ???
Bn Hiç Bişi Anlamadım Çok Detaya Girilmiş Yinede Emeğne Sağlık…Bakmak İstediğim Sadece Periyodik Tablonun Temel Özellikleriydi…
teşekkürler, güzel site
45 yaşında açık öğretim lise ögrencisiyim ders kitabımdan anlayamadıklarımı burdan çok iyi anladım emeği geçenlere çok tşk ederim :)
Yanlış diyenler nerenin yanlış olduğunu yazabilir mi?
çoğu yanlış
tam bu şekilde video su yok mu acaba?
işime yaramadı üzgünüm teşekür edemicem çogu şey yanlış, eksik ve cümle kurmada hatalar var.
Cok guzel olmus emeginize saglik.
atomun yarıçapı ile ilgili bilgiler yanlış
teşekürler
çok işime yaradı teşekkürler:)
allah razı olsun kardeşim emeğinize sağlıkk
ben proje ödevi yapıcam da bunu böylece yazsam bir bölümünee olur mu ?
çok güzel hazırlamışşnz wala teşekkürler emekleriniz için :)
hiç beyenmedim iyi hazırlanmamış
çok saolun .. emeğinize sağlık ..
yarın kimya sınavım var bundan iyi anlatım bulamadım sınavı olacaklar buradan gönül rahatlığıyla çalışabilir çok yararlı bir site para vermeden video dersi bile izleyebiliyorsun dershaneye gitmeyenler için harika . éLiNizé SagLıg . . !
iiiiiyiii diyemicem ama hakkınıda yemiyecem
her şeye rahmen çok faydalandım bir çok kaynaha göre daha önemli notlar olanlar yayınlanmıs teşekkürler ederim tablo çok iyi…
bana çok yardımcı olmadıda ama yinede teşekkürlerrler
çook güze yapmişşniz helal varoll tm
Keep it up
teşekkürler..